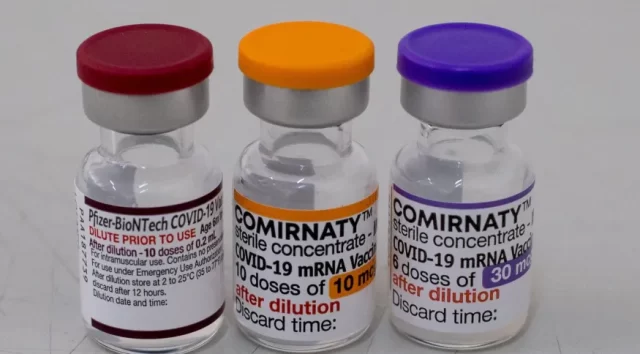
A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou a ampliação do prazo de validade das vacinas monovalentes da Pfizer, contra a Covid-19, para 18 meses.
De acordo com a Anvisa, a ampliação se aplica a todas as apresentações do produto produzidas a partir de hoje e autorizadas para uso em crianças a partir de 6 meses de idade, adolescentes e adultos.
A aprovação, segundo a Anvisa, se baseou em novos dados de estudos de estabilidade realizados pela Pfizer. Os resultados demonstraram não haver alteração nas especificações de qualidade da vacina no período adicional ao prazo anteriormente autorizado.
Para a administração dos lotes já produzidos e distribuídos no país, mas que estão identificados com o prazo de validade antigo, a empresa foi orientada a solicitar uma autorização excepcional de uso à Anvisa.
Neste pedido, a Pfizer deve comprovar a adequada rastreabilidade dos lotes, de modo que os profissionais de saúde e os indivíduos que recebam a vacina possam prontamente verificar a data correta de validade no momento da sua aplicação.
Para as versões bivalentes do imunizante, que contêm cepas específicas da variante Ômicron do vírus causador da Covid-19, não houve alteração do prazo previamente aprovado.
FONTE: Por CNN