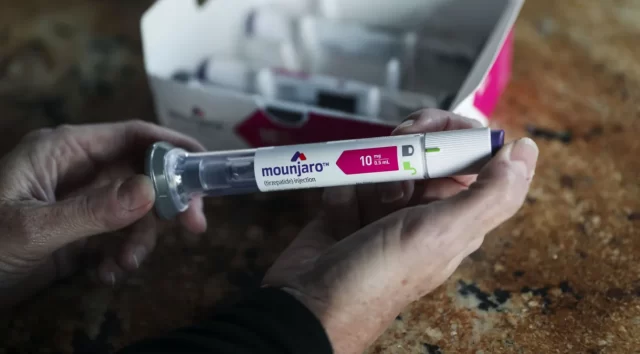
O medicamento tirzepatida, vendido sob a marca Mounjaro, teve o registro da Agência Nacional de Vigilância Sanitária (Anvisa) publicado, nesta segunda-feira (25), no Diário Oficial da União.
A injeção do Mounjaro, que teve uso aprovado nas concentrações de 5 mg/mL, 10 mg/mL, 20 mg/mL, 25 mg/mL e 30 mg/ML, serve para o tratamento da diabetes mellitus tipo 2.
Segundo a agência, ele tem efeito superior a concorrentes – como o Ozempic, outro famoso medicamento para diabéticos.
Veja: 10 dicas para o uso racional de medicamentos









Segundo a agência, ele tem efeito superior a concorrentes – como o Ozempic, outro famoso medicamento para diabéticos.
Assim como o Ozempic, o Mounjaro provoca perda de peso, tendo efeito para o controle do sobrepeso e obesidade.
No registro, a Anvisa destacou que o medicamento é indicado para uso em conjunto com a realização de dieta e exercícios “para melhorar o controle glicêmico de adultos com diabetes mellitus tipo 2”.
“Estudos evidenciaram que a tirzepatida reduz efetivamente a HbA1c [hemoglobina glicada] e espera-se que resulte em redução do risco de doença microvascular a longo prazo, prevenindo cegueira, insuficiência renal com necessidade de diálise e amputação devido à neuropatia”, disse a Anvisa.
“Além disso, a tirzepatida parece fornecer controle glicêmico superior a algumas outras terapias disponíveis. Outro benefício dessa droga é a mudança favorável do peso corporal (perda de peso), uma vez que o sobrepeso e a obesidade contribuem para a fisiopatologia do diabetes mellitus tipo 2”, acrescentou.
Outra terapia disponível para o tratamento do diabetes tipo 2 é a semaglutida, presente no Ozempic, que foi registrado pela Anvisa em julho do ano passado.
Em janeiro deste ano, a agência aprovou o medicamento Wegovy, que utiliza o mesmo princípio ativo, mas com o tratamento indicado exclusivamente para obesidade e sobrepeso, não para diabetes.
Segundo a Anvisa, as reações adversas mais comuns relacionadas ao Mounjaro “estão relacionadas à tolerabilidade gastrointestinal e diminuição do apetite”.
“Essas reações adversas são facilmente identificáveis por pacientes que podem optar por descontinuar a terapia sem danos residuais e espera-se que a dose seja titulada clinicamente de acordo com a tolerabilidade e as necessidades de controle glicêmico”, concluiu a agência.
FONTE: Por CNN





































